Santé
Burkina Faso: Des essais cliniques non autorisés sur le traitement du COVID-19
Publié le lundi 28 decembre 2020 | Netafrique.net
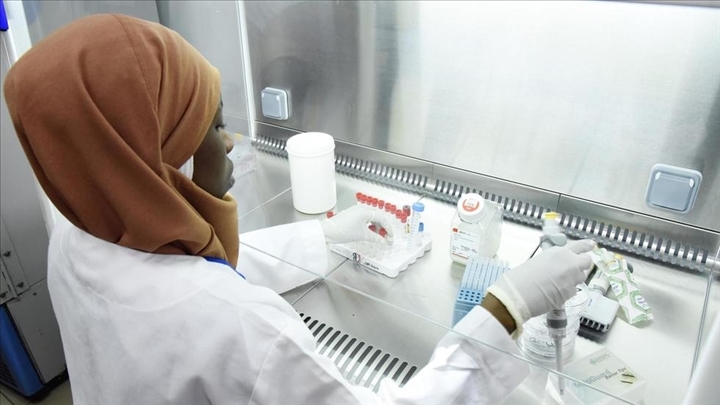
© Autre presse par DR
Une scientifique fait des recherches sur le coronavirus, au laboratoire de l`Institut Pasteur à Dakar, le 3 février 2020
|